|
Гуморальный и клеточный иммунный ответ после двукратного введения вакцины BNT162b2 у людей старшего возраста, ранее болевших и не болевших новой коронавирусной инфекцией SARS-CoV-2
Для оценки особенностей формирования иммунного ответа после вакцинации против COVID-19 в старшем возрасте, в зависимости от наличия в анамнезе коронавирусной инфекции, в Lille University Hospital (Франция) было проведено проспективное клиническое исследование в период с декабря 2020 года по апрель 2021 года. В исследовании участвовало 130 специалистов здравоохранения молодого возраста (18-65 лет, медиана 44,0 года) и 106 людей старшего возраста, пребывавших в стационарах длительного ухода (старше 65 лет, медиана 86,5 лет). Число ранее переболевших COVID-19 участников составило 9 из 130 молодого возраста и 48 из 106 старшего возраста. В ходе исследования проводилась оценка гуморального и клеточного иммунитета после полного завершения курса вакцинации препаратом BNT162b2 (Pfizer-BioNTech) через 90 дней после первого введения вакцины. Оценка гуморального иммунитета проводилась путем определения антител IgG к S1-домену SARS-CoV-2 при помощи наборов для иммуноферментного анализа (Euroimmun QuantiVac ELISA (IgG), Германия), нейтрализующих антител - в тесте нейтрализации живого вируса (LV-NT) и тесте нейтрализации псевдовируса (pV-NT), клеточного иммунитета - путем оценки высвобождения интерферона-гамма (ИФН-гамма, ELISpot) и поверхностных маркеров индуцированной активации (surface activation-induced markers, AIM). Функциональные свойства CD4+ и CD8+ Т-лимфоцитов оценивали путем определения внутриклеточной продукции ИФН-гамма, интерлейкина-2 (ИЛ-2) и фактора некроза опухоли альфа (TNFα) при помощи проточной цитометрии (Beckman Coulter). Основной задачей исследования являлось сравнение иммунного ответа у лиц старшего и молодого возраста, ранее не болевших COVID-19. В день первого введения вакцины (Д0) у участников исследования, ранее не болевших COVID-19, отсутствовали антитела IgG к S1-домену SARS-CoV-2 и нейтрализующие антитела. К 90-му дню после первого введения вакцины (Д90) антитела IgG к S1-домену были выявлены в обеих группах (у 99.2% лиц молодого возраста и у 97.2% лиц старшего возраста), однако медиана титра антител IgG к S1-домену в группе лиц старшего возраста была в 2 раза ниже (P < 0.001, Рис. 1а).
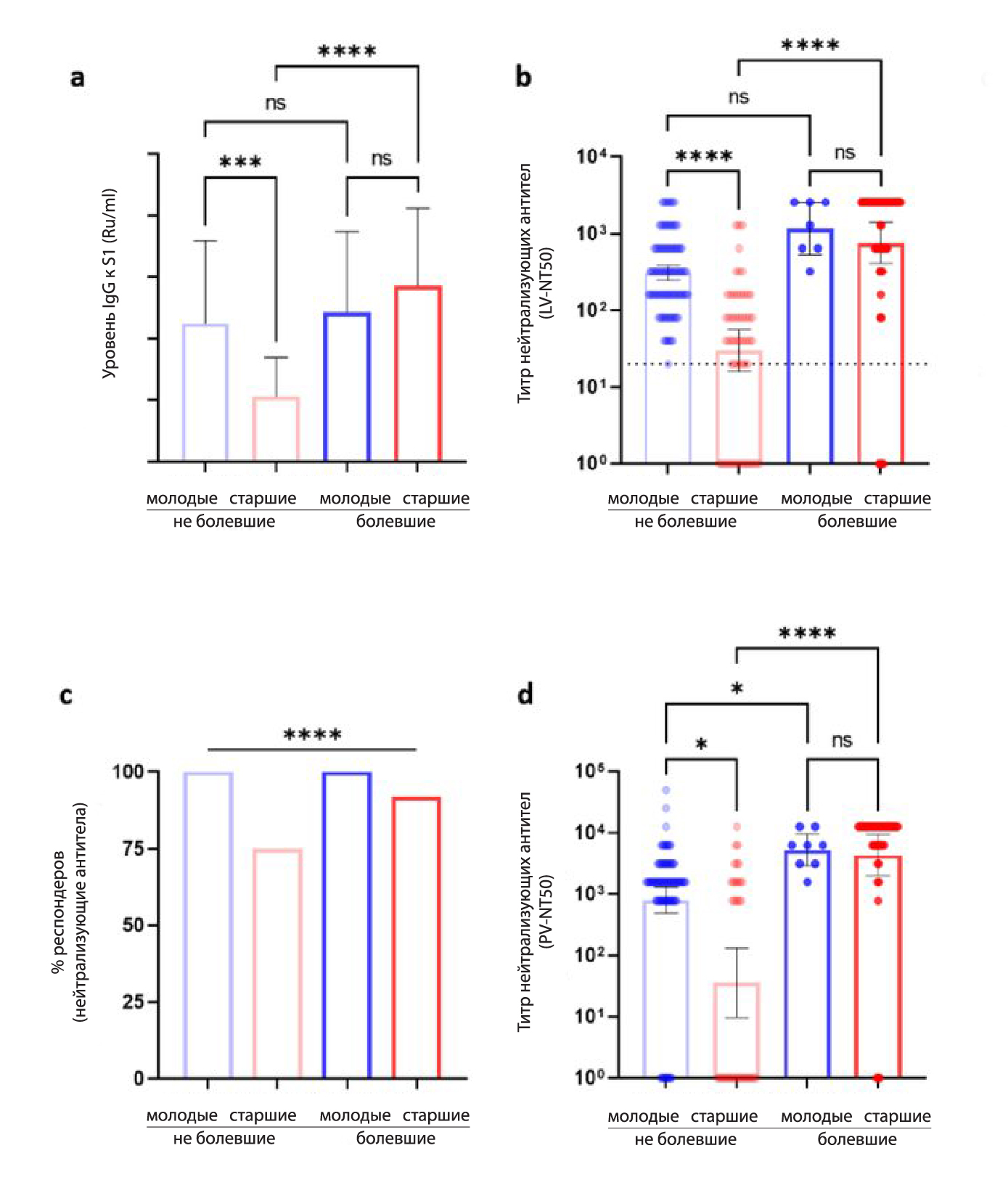
Рисунок 1. Специфический гуморальный ответ через 3 мес. после вакцинации. Значения р * < 0.05, ** < 0.01, *** < 0.001, **** < 0.0001, ns: - не значимо
При определении нейтрализующих антител наблюдались более выраженные различия, среднее геометрическое значение титра нейтрализующих антител NT50 было в 10,2 раза ниже в группе лиц старшего возраста (LV-NT, Рис. 1b) (среднее [95% ДИ] 29.8 [16.0;55.2] в сравнении с 305.0 [243.1;382.6]; медиана [IQR]: 40.0 [5.7;160.0] в сравнении с 320.0 [160.0;640.0], P < 0.0001). Количество респондеров (лиц, у которых были выявлены нейтрализующие антитела) среди лиц, не болевших ранее COVID-19, составило 76.5% (39 из 51, у кого проводилось определение) среди лиц старшего возраста и 100% (101 из 101) среди лиц молодого возраста (P < 0.0001, Рис. 1c). При оценке pV-NT50 были получены сходные средние значения NT50 (Рис. 1d).
При оценке клеточного иммунного ответа при помощи ELISpot была выявлена меньшая выраженность в группе лиц старшего возраста: число реактивных к S1 Т-лимфоцитов составило 13.5 [25.0-27.57] в сравнении с 29.5 [15.0;46.5] у молодых (P = 0.002). При сравнении показателей гуморального и клеточного иммунитета у лиц старшего возраста, ранее болевших COVID-19, с ранее не болевшими, было показано, что вакцинация приводила к более выраженному повышению уровня антител IgG к S1-домену (QuantiVac) и нейтрализующих антител, числа Т-лимфоцитов, секретирующих ИФН-гамма (ELISpot), и AIM+ CD8+ T-лимфоцитов у лиц, ранее болевших COVID-19. Количество респондеров (лиц, у которых были выявлены нейтрализующие антитела) среди лиц старшего возраста, ранее болевших COVID-19, составило 92.2%, в сравнении с 76.5% среди ранее не болевших лиц старшего возраста (P < 0.0001, Рис. 1c).
При изучении продукции цитокинов было выявлено, что число ИФНγ+ и ИФНγ+Ил-2+ФНОα+ (три+) CD4+T-лимфоцитов было ниже в группе лиц старшего возраста, ранее не болевших COVID-19, чем у не болевших молодых участников, однако более чем в 3 раза выше у лиц старшего возраста, ранее болевших COVID-19, чем среди ранее не болевших лиц старшего возраста. Среди лиц, ранее не болевших COVID-19, число AIM+IL-2+CD8+ Т-лимфоцитов было выше в группе старшего возраста, чем в группе молодых участников.
При проведении автоматизированного кластерного анализа субпопуляций Т-лимфоцитов была подтверждена менее выраженная продукция цитокинов у лиц старшего возраста, не болевших COVID-19, по сравнению с ранее болевшими и молодыми участниками. Также было показано более высокое соотношение CD8+/CD4+ среди AIM+ T-лимфоцитов у переболевших участников старшего возраста. На основании полученных результатов авторы пришли к выводу о меньшей выраженности поствакцинального иммунного ответа у лиц старшего возраста, ранее не болевших COVID-19, по сравнению с молодыми участниками. У лиц старшего возраста, ранее перенесших COVID-19, выраженность специфического иммунного ответа была выше, чем у ранее не болевших.
|
Опыт применения QuantiVac ELISA (IgG): контроль иммунного ответа при вакцинации препаратом Pfizer–BioNTech BNT162b2
17.09.2021
17.09.2021

